Методические рекомендации по подготовке к ЕНТ химия
Методические рекомендации по подготовке к ЕНТ
(Тема «Окислительно-восстановительные реакции»)
При подготовке к заданиям по теме «Окислительно-восстановительные реакции» можно решить задания:
Вариант 1Определите вид связи. Обведите в таблице соответствующие цифры.
Подсчитайте сумму цифр.
|
Формула\ вид связи |
Ковалентная полярная
|
Ковалентная неполярная |
Ионная |
|
K2S |
1 |
2 |
3 |
|
H2S |
4 |
5 |
6 |
|
O2 |
7 |
8 |
9 |
Вариант 2
Определите вид связи. Обведите в таблице соответствующие цифры.
Подсчитайте сумму цифр.
|
Формула\ вид связи |
Ковалентная полярная
|
Ковалентная неполярная |
Ионная |
|
КОН |
1 |
2 |
3 |
|
LiF |
4 |
5 |
6 |
|
HNO3 |
7 |
8 |
9 |
Вариант3
Определите вид связи.Обведите в таблице соответствующие цифры.
Подсчитайте сумму цифр.
|
Формула\ вид Связи |
Ковалентная полярная
|
Ковалентная неполярная |
Ионная |
|
Al2O3 |
1 |
4 |
7 |
|
PH3 |
2 |
5 |
8 |
|
K2O |
3 |
6 |
9 |
Задание «Крестики-нолики»Вычеркните прямой линией 3 вещества, в которых хлор имеет одну и ту же степень окисления.
|
SF4 |
SO2 |
K2SO3 |
|
CuS |
K2S |
H2SO3 |
|
H2SO4 |
H2S |
Na2SO3 |
Инструкция к составлению окислительно-восстановительных реакций.
1.Определяем степени окисления до и после реакции.
2.Выделяем элементы, в которых изменилась СО-степень окисления (« находим парочки»)
3.Составляем уравнения электронного баланса. Помним, что число принятых и отданных электронов равно.

4. Расставляем коэффициенты в данном уравнении:
8AL+30HNO3→8AL(NO3)3 +3NH4NO3+9H2O
Порядок действий
•Расставляем коэффициенты баланса электронов.
•Подсчитываем количество атомов алюминия, азота, водорода.
•Проверяем правильность расстановки коэффициентов по кислороду.
5.Определяем окислитель и восстанолвитель:
AL -повышает СО-восстановитель
N -понижает СО-окислитель
Помните!
•Степень окисления кислорода -2, водорода+1.
•Металлы в соединениях имеют +СО
•Степени окисления элементов простых веществ равны нулю (Н20)!
В химической формуле алгебраическая сумма степеней окисления равна нулю!
Окислительно-восстановительные реакции всегда сопровождаются изменением степени окисления элементов, которое связано с переходом электронов от одного атома к другому.
Окисление –процесс отдачи электронов К0-1е=К+1
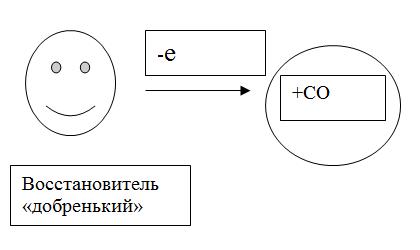
Степень окисления(СО)повышается
Восстановление- процесс присоединения электронов S0+2e=S2-
Степень окисления уменьшается
Тест по теме «Окислительно-восстановительные реакции.
Степень окисления. Кристаллические решетки»
1.Степень окисления хлора в соединении KCIO3: A) +5 B) +3 C) +1 D) +7 E) – 1
2.Степень окисления хлора в соединении НCIO4: A) +5 B) +3 C) +1 D) +7 E) – 1
3.Степень окисления алюминия в соединениях равна: A) +1 B) +3 C) +5 D) - 3 E) – 1
4.Степень окисления кислорода в соединениях чаще всего равна: A) +1 B) - 1 C) +2 D) - 2 E) 0
5.Ионную кристаллическую решетку имеет: A) NaF B) H2O C) Br2 D) H2S E) СuО
6.Молекулярную кристаллическую решетку имеет: A) алюминий B) SО2 C) КCI D) графит E) железо
7.При взаимодействии с металлами неметаллы проявляют свойства: A) восстановительные B) окислительные C) нейтральные D) кислотные E) основные
8.Ионную кристаллическую решетку имеет: A) NaF B) H2O C) алмаз D) Fe E) СаО
9.В какой из этих реакций металл проявляет восстановительные свойства? A) Na2SO4 + BaCI2 →BaSO4 + 2NaCI B) Cu + 2H2SO4 (k) →CuSO4 +2H2O +SO2 C) K2CO3 + 2HNO3→2KNO3 + H2O + CO2 D) MgO + CO2 →MgCO3 E) NaOH + HCI →NaCI + H2O
10.Какое вещество в реакции Fe2O3 + H2 →Fe + H2O является окислителем: A) Fe2O3 B) H2 C) Fe D) H2O E) эта реакция не окислительно-восстановительная
11.Коэффициент перед формулой окислителя в уравнении реакции между алюминием и бромом равен: A) 1 B) 2 C) 3 D) 4 E) 5
12.Наивысшей электроотрицательностью обладает: A) Na B) C C) O D) N E) F
13.В уравнении реакции, схема которой Fe2O3 + H2 →Fe + H2O, коэффициент перед восстановителем равен: A) 1 B) 2 C) 3 D) 4 E) 5
14.Коэффициент перед формулой окислителя в уравнении реакции, схема которой Fe + О2 → Fe2O3, равен: A) 1 B) 2 C) 3 D) 4 E) 5
15.Коэффициент перед формулой окислителя в уравнении реакции, схема которой P + HNО3 + H2O → NO + H3PO4, равен: A) 1 B) 6 C) 3 D) 4 E) 5
16.Окислителем в уравнении реакции 2AI + 6HCI→ 2AICI3 + 3H2, является: A) AI B) HCI C) AICI3 D) H2 E) нет окислителя
17.Коэффициент перед формулой восстановителя в уравнении реакции взаимодействия цинка с водой, равен: A) 1 B) 2 C) 3 D) 4 E) 5
18.В уравнении реакции, схема которой СН4 + О2→ СО2 + H2О коэффициент перед формулой окислителя равен: A) 1 B) 2 C) 3 D) 4 E) 5
19.Коэффициент перед формулой восстановителя в уравнении реакции горении натрия в кислороде: A) 6 B) 2 C) 3 D) 4 E) 5
20.Коэффициент перед формулой восстановителя в уравнении алюминия с оксидом железа (II) равен: A) 1 B) 2 C) 3 D) 4 E) 5
21.Коэффициент перед формулой восстановителя в уравнении реакции магния с азотом равен: A) 1 B) 2 C) 3 D) 4 E) 5
22.Степень окисления хрома в веществе K2Cr2O7 A) +6 B) +12 C) –6 D) – 12 E) +7
23.Степень окисления фосфора в веществах Н3РО4 и Р2О3 соответственно равны: A) – 3, + 5 B) - 3 , + 3 C) +5, +3 D) +3, - 3 E) – 1, +2
24.Коэффициент перед формулой восстановителя в уравнении реакции горения алюминия в кислороде равен: A) 1 B) 2 C) 3 D) 4 E) 5
25.При взаимодействии с неметаллами металлы проявляют свойства: A) окислительные B) кислотные C) восстановительные D) основные E) нейтральные
26.Кристаллическая решетка твердого оксида углерода (IV): A) ионная B) атомная C) молекулярная D) металлическая E) нет правильного ответа
27.Кристаллическая решетка алмаза: A) ионная B) атомная C) молекулярная D) металлическая E) нет кристаллической решетки
28.При взаимодействии с хлором железо проявляет свойства: A) окислительные B) кислотные C) восстановительные D) основные E) нейтральные
29.В какой из этих реакций металл проявляет восстановительные свойства? A) Na2SO4 + BaCI2 ®BaSO4 +2NaCI B) Cu +2H2SO4 (k) ®Cu SO4 + 2H2O +SO2 C) K2CO3 +2HNO3 ®2KNO3 + H2O +CO2 D) Mg(NO3)2 + 2HCI ® MgCI2 +2HNO3 E) FeCI2 + Na2SO4O4FeSO4 +2NaCI
30.Коэффициент перед формулами восстановителя и окислителя в уравнении реакции, схема которой Р + KCIO3 → KCI + P2O5 : A) 5 и 6 B) 6 и 5 C) 3 и 5 D) 5 и 3 E) 7
Тест Химическая связь и строение молекул
1. Азот – окислитель в химической реакции
A) N2 + 6Na = 2Na3N
B) 4NH3 + 3O2 = 2N2 + 6H2O
C) N2 + O2 = 2NO
D) 4NO2 + 2H2O + O2 = 4HNO3
E) 2NO + O2 = 2NO2
2. Металлическая связь – это связь между …
A) молекулами металлов
B) атомами и ионами металлов
C) положительными ионами металлов, атомами металлов и свободными электронами в кристаллической решетке
D) положительными ионами металлов и протонами
E) ионами металлов
3. Степень окисления элемента равна нулю, а валентность – единице в молекуле
A) Н2О
B) F2
C) NH3
D) HCl
E) N2
4.В молекуле кислорода связь
A) Ионная
B) Донорно-акцепторная
C) Ковалентная полярная
D) Металлическая
E) Ковалентная неполярная
5. Степень окисления азота в ионе аммония равна A) +5 B) -3 C) -4 D) +3 E) +4
6 Фосфор – только восстановитель в химической реакции:
A) 2P + 3Ba = Ba3P2
B) 2P + 3H2 = 2H3P
C) 2P + 3Cl2 = 2PCl3
D) 4P + 3KOH + 3H2O = PH3 + 3KH2PO2
E) P + 3K = K3P
7. Только ковалентная полярная связь в
A) HCl
B) C2H5ONa
C) Cu
D) H2
E) Al2O3
8. В реакции Zn + H2SO4 (разб) → … восстанавливается
A) О-2
B) Zn0
C) S+4
D) H+1
E) S+6
9 К окислительно-восстановительным реакциям не относится
A) Осаждение меди на железном гвозде, опущенном в раствор медного купороса
B) Электролиз расплава хлорида натрия
C) Сгорание серы
D) Разложение голубого осадка гидроксида меди (II)
E) Выделение газа при внесении калия в воду
10. В образовании металлической кристаллической решетки принимают участие
A) Электроны, анионы, атомы
B) Только катионы металлов
C) Только атомы металлов
D) Только электроны
E) Электроны, катионы, атом
11.Сумма коэффициентов в левой части уравнения реакции
H2S + KMnO4 = K2SO4 + MnO2 + KOH + H2O
A) 9
B) 5
C) 11
D) 7
E) 8
12. Ряд возрастания восстановительных свойств
A) O, S, Se, Te, Po
B) Po, Se, O, S, Te
C) Se, O, S, Po, Te
D) Po, Te, Se, S, O
E) S, Se, Te, Po, O
13 Валентный угол при sp2 – гибридизации электронных облаков
A) 120о
B) 105о
C) 109о28
D) 180о
E) 107о
14. Число -связей в NaClO4 равно
A) 3
B) 7
C) 5
D) 4
E) 6
15. Коэффициент перед формулой восстановителя в уравнении взаимодействия разбавленной азотной кислоты с фосфором, если получается H3PO4 и NO, равен
A) 5
B) 3
C) 2
D) 4
E) 7
16 Химическая связь в NaClO4
A) ковалентная неполярная и полярная
B) ковалентная полярная и ионная
C) ковалентная полярная и металлическая
D) ионная и металлическая
E) ионная и водородная
17. Наименьшую степень окисления имеет фосфор в соединении:
A) H3PO4
B) HPO3
C) P2O5
D) H3P
E) P2O3
18. Сумма всех коэффициентов в уравнении окислительно-восстановительной реакции
SO2 + H2O + KIO3 → KI + H2SO4
A) 12
B) 10
C) 11
D) 8
19 Степень окисления металлов
A) равна 0
B) всегда отрицательная
C) всегда положительная
D) может быть и положительной, и отрицательной
E) положительная или равна 0
20. Линейное строение молекулы характерно для
A) Метана B) Углекислого газа
C) Аммиака D) Хлорида бора E) Воды
21. В схеме превращений
S SO2 →1→ SO3 →2→ H2SO4 →3→ K2SO4 →4→ BaSO4
окислительно-восстановительными реакциями будут
A) 1, 5 B) 1, 3 C) 3, 5 D) 1, 2 E) 1, 4
22 Валентность и степень окисления азота в азотной кислоте равны
A) V и +5 B) V и -5 C) IV и +5 D) IV и +3 E) V и +3
23 Процесс окисления
A) Cl+7 → Cl-1
B) Cu+2→ Cu0
C) O0 → O-2
D) N-3→ N+2
E) Fe+3 → Fe+2
24 Для металлов характерен тип химической связи:
A) Металлическая
B) Ионная
C) Ковалентная неполярная
D) Водородная
E) Ковалентная полярная
25 Водородная связь не образуется между молекулами:
A) Нуклеиновых кислот
B) Предельных низших спиртов
C) Одноатомных низших спиртов
D) Карбоновых кислот
E) Алкинов
26. Сумма коэффициентов в реакции взаимодействия концентрированной серной кислоты с кальцием:
A) 18
B) 10
C) 16
D) 12
E) 8
27 Соединения с ионной связью:
A) I2, H2
B) C2H5OH, CH3COOH
C) O2, H2O
D) Fe, CuO
E) NaCl, BaCl2
28. Если взаимодействуют по реакции
C + HNO3 → CO2 + NO + H2O 6 моль восстановителя, то масса окислителя равна (в г)
A) 54 B) 504 C) 120 D) 126 E) 63
29 Связь, возникающая между атомом водорода одной молекулы и сильно электроотрицательным атомом другой молекулы, называется:
A) металлической
B) водородной
C) ковалентной
D) ионной
E) донорно- акцепторной
30. Сумма всех коэффициентов в уравнении взаимодействия
KMnO3 + H2SO4 + KJ MnSO4 + H2O + J2 + K2SO4
A) 36
B) 30
C) 41
D) 31
E) 47
2Вариант
1. В молекуле NaCl тип химической связи
A) Металлическая
B) Ковалентная неполярная
C) Водородная
D) Ионная
E) Донорно-акцепторная
2. Фосфор – окислитель при взаимодействии с:
A) Азотной кислотой
B) Хлором
C) Хлоратом калия
D) Кислородом
E) Магнием
3 Частицы с неспаренными электронами, образующиеся при разрыве ковалентной связи
A) Анионы B) Радикалы C) Катионы
D) Атомы E) Ионы
4. Электронная конфигурация Fe2+
A) …3d3 4s2
B) …3s2 3p6
C) …3d6 4s0
D) …3d6 4s2
E) …4s2 4p6
5 Характерная степень окисления меди
A) +6 B) +5 C) +3 D) +4 E) +2
6 Соединения с ковалентной полярной связью:
A) O2, H2O
B) C2H5OH, CH3COOH
C) NaCl, H2SO4
D) Fe, CuO
E) Cl2, H2
7 Степень окисления серы +4 в соединении:
A) H2S
B) H2SO4
C) SO3
D) H2SO3
E) CaSO4
8Даны: а) MgCl2 б) J2 в) HClO г) NaClO4 д) KClO3
Ряд веществ с окислительно-восстановительной двойственностью
A) в, г, д
B) а, в, г
C) б, в, д
D) а, б, д
E) б, в, г
9. Степени окисления железа в соединениях FeO, Fe2O3 соответственно:
A) +2; +1
B) +2; -3
C) +1; +3
D) -1; +1
E) +2; +3
10. Соединения с ковалентной полярной связью:
A) C2H5OH, CH3COOH
B) NaCl, H2SO4
C) Fe, CuO
D) O2, H2O
E) Cl2, H2
11 Сера имеет степень окисления (-1) в соединении:
A) SO2
B) SO3
C) FeS
D) H2S
E) K2S2
12.Схеме превращений
S2- → S0 → S+4 → S+6 → S-2
Может соответствовать превращение A) H2S → S → SO2 → H2 →SO3
B) Na2S → S → SO3 → SO2 → S
C) FeS → SO2 → SO3 →S → H2S
D) FeS2 → S →SO3 → SO2 → H2S
E) H2S → S → SO2 → SO3 → H2S
13. При окислении происходит
A) Отдача электронов атомом, молекулой или ионом
B) Присоединение электронов
C) Перемещение электронной пары
D) Образование общей электронной пары
E) Завершение внешнего энергетического уровня
14 Оба вещества могут быть только окислителями:
A) SO3 H2SO3
B) HNO3 H3PO4
C) SO2 CO2
D) SO2 H2SO4
E) NO HNO3
1A 2C 3B 4E 5B 6C7A 8D9D 10E11C 12A 13A 14A 15B 16B 17D18C 19E 20B 21D 23D 24A 25E 26A 27E28B 29B 30B
1D 2E 3B 4C 5E6B7D8C 9E 10A 11E 12E 13A!4В
Решение задачи
- Запишите краткое условие задачи( Дано: Найти:)
- Если в условии задачи указаны массовые доли примесей или растворённого вещества, то найдите их.
( w(в-ва) = υMв-ва/m(р-ра) или V(р-ра) *ρ,
m(в-ва)=w(прим)*m(руды).
- Все данные величины переводим в моли. Если дана масса
m - -> υ=m/M , если объём V -> υ=V/Vm
4. Запишите уравнение реакции. Например
2моль х моль
2Н2+О2=2Н2О
2моль 1 моль. Подчеркните указанные в условии вещества. Обозначьте неизвестное вещество за х моль и подпишите сверху над веществом.
- Под формулами подпишите количество молей согласно коэффициентам.
- Найдите х.( х=2,5 моль)
- Если нужно найти массу m=υM, если объём
V=υVm ( V(О2)=2,5моль*22,4л./моль=56 л)
7. Запишите ответ.
Тест по теме «Расчеты по химическим уравнениям»
Вариант 1
1.Масса соли, образовавшейся при нагревании 200 г оксида меди (II) с 200 г серной кислоты, равна: A) 400 г B) 32,7 г C) 326,5 г D) 432,7 г E) 300 г
2.Масса соли, образовавшейся при пропускании 5,6 л (н.у.) хлорводорода через раствор, содержащий 11,2 г гидроксида калия, равна: A) 5,6 г B) 11,2 г C) 14,9 г D) 18,6 г E) 20 г
4.Сколько граммов фосфора необходимо для получения 71 г оксида фосфора (V): A) 31 г B) 60 г C) 97 г D) 101 г E) 141 г
5.При растворении 10 г гидроксида натрия в 30 г воды получается раствор с массовой долей щелочи: A) 5% B) 10% C) 15% D) 20% E) 25%
6.Для приготовления 100 г 15%-ного раствора необходимо взять соли: A) 5 г B) 10 г C) 15 г D) 20 г E) 25 г
7.Для приготовления 400 г 2%-ного раствора соли необходимо взять соль, масса которой: A) 2 г B) 4 г C) 6 г D) 8 г E) 10 г
8.Массовая доля растворенного вещества в растворе, приготовленном из 120 г воды и 40 г соли равна: A) 25% B) 20% C) 30% D) 35% E) 40%
9.В 35 г воды растворили 15 г соли. Массовая доля полученного раствора равна: A) 5% B) 15% C) 20% D) 30% E) 35%
10.Найти массу соли, необходимую для приготовления раствора массой 230 г и массовой долей 46%: A) 46 г B) 23 г C) 105,8 г D) 73,6 г E) 97,7 г
11.В 100 г воды растворили 10 г соды. Какова массовая доля полученного раствора: A) 27% B) 33 % C) 17% D) 9% E) 100%
12.После выпаривания 80 г раствора осталось 20 г соли. Массовая доля раствора была: A) 20% B) 25% C) 30% D) 35% E) 40%
13.После выпаривания 160 г раствора осталось 40 г соли. Массовая доля соли в растворе была: A) 20% B) 25% C) 30% D) 35% E) 40%
14.Для приготовления 5%-ного раствора необходимо 2 г сахара растворить в воде, масса которой равна: A) 19 г B) 20 г C) 40 г D) 38 г E) 52 г
15.В 30 г воды растворили 20 г гидроксида калия. Массовая доля щелочи в растворе равна: A) 10% B) 20 % C) 30% D) 40% E) 50%
16.В 250 г воды растворили 20 г соли. Массовая доля полученного раствора равна: A) 8% B) 7,4 % C) 20% D) 2,5% E) 67%
17.Какой объем занимает 4,5 моль кислорода: A) 16 л B) 32 л C) 22,4 л D) 100,8 л E) 44,8 л
18.Сколько литров хлора необходимо для реакции со 110,4 г натрия? A) 22,8 л B) 53,76 л C) 36,8 л D) 41,7 л E) 50 л
19.Сколько литров хлора может получиться в результате взаимодействия 182,5 г соляной кислоты с диоксидом марганца? A)10 л B) 11,6 л C) 47 л D) 28 л E) 36,5 л
20.При сливании растворов, содержащих 84 г карбоната натрия и 0,5 моль хлороводорода, объем (н.у.) выделившегося газа, равен: A) 16,7 л B) 20,4 л C) 10,2 л D) 5,6 л E) 22,4 л
21.Какой объем занимает 3,2 моль азота: A) 22,4 л B) 71,68 л C) 77 л D) 191 л E) 28 л
22.Объём водорода (н.у.), образующегося при взаимодействии 13 г цинка с 24,5 г серной кислоты, равен: A) 2,24 л B) 4,48 л C) 6,72 л D) 8,96 г E) 3,45 г
23.Cколько литров кислорода может получиться при разложении 94,8 г KMnO4: A) 5 л B) 28 л C) 16 л D) 64 г E) 6,72 г
24.Найти массу кальция, необходимую для получения оксида кальция массой 112 г: A) 20 г B) 40 г C) 60 г D) 80 г E) 100 г
25.Сколько граммов натрия нужно для реакции с 11,2 л кислорода? A) 46 г B) 23 г C) 10 г D) 50 г E) 69 г
26.Сколько граммов кальция нужно для получения 33,6 г оксида кальция? A) 40 г B) 24 г C) 100 г D) 20 г E) 17 г
27.Сколько граммов натрия нужно для реакции с 10 г соляной кислоты? A) 23 г B) 46 г C) 10 г D) 6,3 г E) 12,6 г
28.Масса сульфида цинка, образовавшегося при нагревании 10 г серы с цинком, равна: A) 12 г B) 25,6 г C) 30,31 г D) 10,5 г E) 32,4 г
29.Объем углекислого газа, образующегося при сжигании 32 г метана (СН4), равен: A) 22,4 л B) 44,8 л C) 2 моль D) 44 г E) 22,4 г
30.При нагревании 5,4 г алюминия с 5,76 г серы образуется сульфид алюминия массой: A) 5,76 г B) 7,50 г C) 11,6 г D) 9 г E) 11,2 г
31.Масса железа, которое можно получить из 1 т красного железняка (Fe2O3), содержащего 30% примесей, равна: A) 245 кг B) 350 кг C) 490 кг D) 700 кг E) 920 кДж
32.Сколько граммов натрия необходимо для получения 187,2 г хлорида натрия? A) 147,2 г B) 73,6 г C) 220,8 г D) 36,8 г E) 18,4 г
33.При обжиге известняка массой 2 г образовалось 336 мл (н.у) углекислого газа. Массовая доля примесей (%) в известняке равна: A) 25 B) 40 C) 60 D) 75 E) 55
34.Масса сульфида цинка, образовавшегося при нагревании 10 г цинка и 10 г серы, равна: A) 10 г B) 14,9 г C) 20 г D) 24,9 г E) 30 г
35.Масса цинка, необходимого для получения 6 моль водорода при взаимодействии с соляной кислотой, равна: A) 65 г B) 130 г C) 260 г D) 390 г E) 520 г
36.При нагревании 5,4 г алюминия с 5,76 г серы образуется сульфид алюминия массой: A) 4,3 г B) 9 г C) 8,5 г D) 7,6 г E) 10 г
37.Через раствор, содержащий 4 г гидроксда натрия, пропустили соляную кислоту. Количество образовавшейся соли равно: A) 0,05 моль B) 5,85 моль C) 0,1 моль D) 4 моль E) 23 моль
38.Количество водорода, выделившегося при взаимодействии 325 г цинка с соляной кислотой равно: A) 1 моль B) 3 моль C) 5 моль D)7 моль E) 9 моль
39.Сколько моль азота необходимо для реакции с водородом, если получается 12 моль аммиака: A) 10 моль B) 8 моль C) 6 моль D)4 моль E) 2моль
40.При пропускании 11,2 л (н.у.) аммиака через раствор, содержащий 1 моль азотной кислоты, образуется количество вещества нитрата аммония, равное: A) 2,5 моль B) 0,8 моль C) 0,5 моль D)1,5 моль E) 4,3 моль
41.Количество оксида фосфора (V), полученного при взаимодействии 0,1 моль фосфора с 11,2 л (н.у.) кислорода равно: A) 0,4 моль B) 0,2 моль C) 0,1 моль D) 0,05 моль E) 2 моль
42.Для получения 10 г водорода при взаимодействии кальция с водой потребуется кальций в количестве: A) 1 моль B) 2,5 моль C) 5 моль D) 10 моль E) 15 моль
43.При сливании растворов, содержащих 84 г карбоната натрия и 0,5 моль хлороводорода, объем (н.у.) выделившегося газа равен: A) 5,6 л B) 11,2 л C) 16,8 л D) 22,4 л E) 30,5 л
44.Объем водорода, выделившегося при действии соляной кислоты на 1,5 моль магния, равно: A) 1,5 моль B) 33,6 л C) 2 л D) 22,4 л E) 36,5 л
Тест по теме «Расчеты по химическим уравнениям»
Вариант 2
1.Объем водорода, выделившегося при взаимодействии 24,5 г серной кислоты с 13 г цинка, равен: A) 10,2 л B) 25 л C) 5,23 л D) 4,48 л E) 12,5 л
2. Сколько литров водорода получится при взаимодействии 29,2 г соляной кислоты с цинком: A) 10 г B) 8,96 г C) 36,5 г D) 11,2 л E) 896 л
3.Найти, сколько граммов составляет 12 моль СаСО3: A) 100 г B) 12 г C) 1200 г D) 8,3 г E) 57 г
4.Сколько граммов серы необходимо для реакции со 100,8 г железа, если в результате получится сульфид железа (11): A) 57,6 г B) 32 г C) 56 г D) 91 г E) 43 г
5.Масса карбоната магния, образовавшегося при сливании растворов, содержащих 53 г карбоната натрия и 38 г хлорида магния, равна: A) 105 г B) 58 г C) 33,6 г D) 40,7 г E) 25,4 г
6.При смешивании 5,9 г аммиака с 5,6 л (н.у.) хлороводорода образуется хлорид аммония массой: A) 5 г B) 5,6 г C) 13,4 г D) 15,7г E) 20,1 г
7.Сколько литров водорода нужно для реакции с бромом, чтобы получилось 150 л HBr? A) 75 л B) 175 л C) 150 л D) 25 л E) 50 л
8.При нагревании 28 г железа с 32 г серы образуется сульфид железа (II) массой: A) 32 г B) 38 г C) 44 г D) 60 г E) 55 г
9.Масса соли, образовавшейся при нагревании 20 г оксида меди (II) с 21 г серной кислоты, равна: A) 16,4 г B) 20,2 г C) 34,3 г D) 42,5г E) 50 г
10.Сколько моль водород выделится при разложении 22 моль воды? A) 2 моль B) 10 моль C) 11 моль D) 22 моль E) 44 моль
11.Масса соли, образовавшейся при нагревании 20 г оксида меди (II) с 21 г серной кислоты, равна: A) 16,4 г B) 20,2 г C) 34,3 г D) 42,5 г E)50,3 г
12.Масса соли, образовавшейся при пропускании 5,6 л(н.у) хлороводорода через раствор, содержащий 11,2 г гидроксида калия, равна: A) 5,6 г B) 11,2 г C) 14,9 г D) 18,6 г E) 20,5 г
13.Количество вещества сульфата калия, образовавшегося при сливании растворов, содержащих 2 моль серной кислоты и 5 моль гидроксида калия, равно: A) 3 моль B) 2 моль C) 7 моль D) 8 моль E) 5 моль
14.Количество вещества хлорида бария, образовавшегося при сливании растворов, содержащих 4 моль соляной кисоты и 5 моль гидроксида бария, равно: A) 3 моль B) 2 моль C) 7 моль D) 8 моль E) 5 моль
15.Количество вещества хлорида баря, образовавшегося при сливании растворов, содержащих 6 моль хлороводорода и 3 моль гидроксида бария, равно: A) 1 моль B) 2 моль C) 3 моль D) 4 моль E) 5 моль
16.Раствор, содержащий 9,8 г серной кислоты, нейтрализовали раствором гидроксида натрия. Количество вещества образовавшейся соли равно: A) 0,05 моль B) 0,01 моль C) 0,1 моль D) 0,2 моль E) 1 моль
17.При пропускании 11,2 л (н.у) аммиака через раствор, содержащий 1 моль азотной кислоты, образуется количество вещества нитрата аммония: A) 0,5 моль B) 0,75 моль C) 9,5 моль D) 4,5 моль E) 0,7 моль
18.Сколько моль водорода необходимо для реакции с оксидом меди (II) массой 4 г? A) 9 моль B) 3 моль C) 1 моль D) 0,5 моль E) 0,05 моль
19.Масса карбоната магния, образовавшегося при взаимодействии 38 г хлорида магния и 53 г карбоната натрия равна: A) 33,6 г B) 42 г C) 53 г D) 95 г E) 105 г
20.Масса углерода, необходимого для получения 224 л углекислого газа, равна: A) 22,4 г B) 224 г C) 120 г D) 12 г E) 1,2 г
21.Масса фосфора, необходимого для получения 0,1 моль оксида фосфора (V), равна: A) 0,2 г B) 3,1 г C) 31 г D) 62 г E) 6,2 г
22.Объём 10 моль кислорода, равен: A) 10 л B) 16 л C) 32 л D) 22,4 г E) 224 4
23.Масса сульфата натрия, образовавшегося при сливании растворов, содержащих 49 г гидроксида натрия и 49 г серной кислоты, равна: A) 49 г B) 71 г C) 87 г D) 98 г E) 102 г
24.Найти количество вещества водорода, необходимо для получения 3 моль соляной кислоты. A) 0,5 моль B) 31моль C) 1,5 моль D) 2 моль E) 2,5 моль
25.При сжигании 4,35 л (н.у.) метана выделилось 173 кДж теплоты. Тепловой эффект Q реакции СН4 + 2О2 =СО2 + 2Н2О + Q A) 173,0 кДж B) 445,0 кДж C) 225,5 кДж D) 250,5 кДж E) 890,9 кДж
26.Термохимическое уравнение реакции СН4 + 2О2 =СО2 + 2Н2О + 880 кДж. Количество теплоты, выделившейся при сжигании 112 л (н.у.) метана (СН4), равно: A) 1100 кДж B) 2200 кДж C) 4400 кДж D) 8800 кДж E) 90000 кДж
27.Термохимическое уравнение экзотермической реакции: A) А + В → Х + Q B) А + В → Х - Q C) А + В → Х D) С + О2 → СО2 E) СаСО3 →СаО + СО2
28.Экзотермической реакцией является: A) C + O2 → CO2 B) 2H2O →2H2 + O2 C) 2HgO → 2Hg + O2 D) PCI5 →PCI3 + CI2 E) 2NH3 → N2 + 3H2
29.Термохимическое уравнение реакции горения магния 2Mg + О2 = 2MgО + 1127 кДж. При сгорании 46,85 г магния выделится теплоты: A) 1100 кДж B) 2200 кДж C) 4400 кДж D) 8800 кДж E) 90000 кДж
30.Термохимическое уравнение реакции сероводорода 2H2S + 3О2 =2SО2 + 2Н2О + 1166 кДж. Количество теплоты, выделившейся при сжигании 11,2 л (н.у.) сероводорода, равно: A) 291,5 кДж B) 583 кДж C) 874,5 кДж D) 1166 кДж E) 2000 кДж
31.Количество теплоты в термохимическом уравнении указывается для: A) 1 г вещества B) 10 г вещества C) 1 моль вещества D) 1 л вещества E) нет правильного ответа
32.Термохимическое уравнение реакции разложения карбоната кальция СаСО3 СаО + СО2 – 178 кДж. Количество теплоты, которое необходимо затратить для разложения 20 г СаСО3, равно: A) 17,8 кДж B) 35,6 кДж C) 71,2 кДж D)35,6 кДж E) 40 кДж
33.При сжигании 2 л (н.у.) ацетилена (С2Н2) выделилось 116 кДж теплоты. Тепловой эффект Q реакции 2С2Н2 + 5О2 =4СО2 + 2Н2О + Q равен: A) 2598,4 кДж B) 1299,2 кДж C) 649,5 кДж D) 324,75 кДж E) 653,4 кДж
34.Термохимическое уравнение реакции магния 2Mg + О2 =2MgО + 1127 кДж. При сгорании 2,4 г магния выделится теплота: A) 11,27 кДж B) 28,175 кДж C) 56,35 кДж D) 112,70 кДж E) 95,6 кДж
35.При сжигании 5,6 л (н.у.) метана выделилось 233 кДж теплоты. Тепловой эффект Q реакции СН4 + 2О2 =СО2 + 2Н2О + Q A) 111,5 кДж B) 223 кДж C) 446 кДж D) 932кДж E) 502 кДж
36.При окислении 1 г глюкозы (С6Н12О6) выделилось 15,64 кДж теплоты. Тепловой эффект Q реакции С6Н12О6+ 6О2 =6СО2 + 6Н2О + Q равен: A) 156,4 кДж B) 281,5 кДж C) 1564 кДж D) 2815,2 кДж E) 1383 кДж
37.Количество теплоты, выделяющееся при сгорании 2 моль водорода в хлоре, если термохимическое уравнение Н2 + CI2 =2НCI + 184,6кДж: A) 369,2 кДж B) 184,6 кДж C) 92,3 кДж D) 18,46 кДж E) 1846 кДж
38.Количество теплоты, выделяющееся при сгорании 2 моль угля термохимическое уравнение С +О2 =СО2 + 393 кДж: A) 393 кДж B) 786 кДж C) 1179 кДж D) 1196,5 кДж E) 3930 кДж
39.При сжигании 2 моль метана выделилось 1604 кДж теплоты. Тепловой эффект Q реакции СН4 + 2О2 =СО2 + 2Н2О + Q A) 1604 кДж B) 802 кДж C) 923 кДж D) 1200 кДж E) 2035 кДж
40.Количество теплоты, выделяющееся при сгорании 2 г угля термохимическое уравнение С +О2 =СО2 + 393 кДж: A) 24 кДж B) 32,75 кДж C) 65,5 кДж D) 393 кДж E) 403 кДж
При сгорании 16 г серы выделяется 148,8 кДж теплоты. Тепловой эффект Q химической реакции S + О2 =SО2 + Q , равен: A) 297,6 кДж B) 148,8кДж C)150 кДж D) 164,5
-
X
Ваше имя:
Ваш email:

Алия 20 January 2017 21:10