Тест по химии 5-10 класс по вариантам
Тест по химии.
I – вариант.
1.Многообразие химических элементов обусловлено:
A) Способностью атомов углерода соединяться между собой и образовывать различные цепи.
B) Окислительно-восстановительными свойствами углерода.
C) Способностью атома углерода образовывать донорно-акцепторные связи.
D) Способностью образовывать различные функциональные группы.
E) Строением ядра атома углерода.
2.Максимальное число электронов на f-подуровне:
A) 10
B) 1
C) 14
D) 6
E) 2
3.К химическим явлениям не относится
A) Таяние льда
B) Брожение ягод
C) Скисание молока
D) Ржавление железа
E) Горение свечи
4.Нерастворимые основания при нагревании разлагаются на
A) Металл и гидроксильную группу.
B) Кислотный оксид и воду.
C) Основной оксид и водород.
D) Металл, водород и кислород.
E) Оксид металла и воду.
5.Кислотные оксиды могут быть:
A) твёрдыми, жидкими и газообразными.
B) только газообразными.
C) только жидкими.
D) только твёрдыми.
E) твёрдыми и газообразными.
6.CaCO3 называют
A) Мел.
B) Медный купорос.
C) Гипс.
D) Пирит.
E) Поваренная соль.
7.Оксид железа (III) относится к:
A) Основным оксидам.
B) Амфотерным оксидам.
C) Несолеобразующим оксидам.
D) Инертным оксидам.
E) Кислотным оксидам.
8.Схема расположения электронов по энергетическим уровням у алюминия
A) 2e)8e)8e)
B) 2e)7e)
C) 2e)8e)3e)
D) 2e)8e)8e)3e)
E) 2e)8e)1e)
9.Основной способ переработки нефти
A) Крекинг
B) Гидролиз
C) Пиролиз
D) Перегонка
E) Риформинг
10.Общая схема реакции этерификации
A) R – OH+R1 – OH → R – O – R1+H2O
B) R – C – OH +R1 – OH → R – С – O – R1+H2O
C) R – CОOH+NaOH →R – CОONa+H2O
D) 2R – OH +2Na → 2R – ONa+H2 ↑
E) R – C – OH+Cl2 →R – CО – OH+HCl
׀ ׀׀
О Cl
11.Формула соответствующая электронной конфигурации внешнего энергетического уровня атома серы:
A) …3s23p5
B) …3s23p4
C) …3s23d4
D) …3s13p4
E) …3s23p6
12.В организме человека кальций концентрируется в костях преимущественно в виде солей
A) Угольной кислоты
B) Азотной кислоты
C) Соляной кислоты
D) Фосфорной кислоты
E) Серной кислоты
13.В состав рибозы входят функциональные группы:
A) 3 гидроксильные группы и 1 альдегидная группа
B) 4 гидроксильные группы и 1 группа кетонов
C) 4 гидроксильные группы и 1 карбоксильная группа
D) 5 гидроксильных групп и 1 группа альдегидов
E) 4 гидроксильные группы и 1 альдегидные группы
14.Уксусную кислоту в промышленности получают реакцией
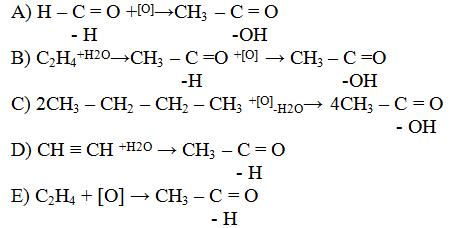
15. Число молей аланина, которое взаимодействовало с 75 г глицина с образованием дипептида
A) 0,75 моль
B) 0,5 моль
C) 1,5 моль
D) 1,25 моль
E) 1 моль
16.Масса бензола, полученная из ацетилена объёмом 22,4 л, если практический выход бензола составляет 40% от теоретического
A) 10,4 г
B) 11,4 г
C) 12,4 г
D) 8,4 г
E) 9,4 г
17.Если при горении 15 г этана выделилось 770 кДж теплоты, то тепловой эффект реакции
A) 5080 кДж
B) 1080 кДж
C) 3080 кДж
D) 2080 кДж
E) 4080 кДж
18.При электролизе раствора гидроксида натрия образуется
A) Na0 и H2o
B) O20 и Na0
C) H20 и O20
D) H20 и Na0
E) H20 и H2O
19.Масса альдегида, полученного из 89,6 л ацетилена
A) 200 г.
B) 210 г.
C) 220 г.
D) 176 г.
E) 150 г.
20.Для получения 1 моль азотной кислоты должны прореагировать объёмы оксида азота (IV), кислорода и воды:
A) 22,4 л; 6 л; 12 мл.
B) 22,4 л; 5,6 л; 9 мл.
C) 2,24 л; 4,8 л; 18 мл.
D) 2,24 л; 48 л; 1,8 мл.
E) 0,224 л; 56 л; 18 мл.
21.Ксантопротеиновая реакция характерна для:
A) Остатков β – аминокислот.
B) Пептидных связей.
C) Остатков аминокислот, содержащих металл.
D) Остатков аминокислот, содержащих S.
E) Остатков аминокислот, содержащих бензольное кольцо.
22.Для получения хлороводорода из хлорида кальция с наибольшим выходом следует использовать концентрированный раствор:
A) H2SiO3
B) CH3COOH
C) H2SO4
D) HF
E) H3PO4
23.Для гомогенной реакции А+В=С при одновременном увеличении молярной концентрации исходных веществ в2 раза скорость реакции
A) Возрастёт в 4 раза.
B) Уменьшится в 2 раза.
C) Возрастёт в 6 раз.
D) Возрастёт в 2 раза.
E) Уменьшится в 4 раза.
24.В схеме превращений веществом С является
C2H2 +HCl→ A +H2t.кат→ B +2Na→ C
A) этилен
B) хлорэтан
C) винилхлорид
D) бутан
E) циклобутан
25. Масса этиленгликоля, которая получится при окислении 11,2 г смеси этана и этена, содержащей 75% этана.
A) 11,6 г
B) 6,2 г
C) 4,2 г
D) 2,2 г
E) 12 г
26.Масса спирта, необходимая для получения 44,8 л этилена (н.у.), при выходе его 50%.
A) 164 г
B) 120 г
C) 118 г
D) 184 г
E) 89,6 г
27.Летучее водородное соединение, являющееся донором электронов, это
A) HF
B) H2
C) SiH4
D) CH4
E) PH3
28.Если схема превращений,
Al +H2O1→ А+Б↑ +3HNO32→ В+Г эл.ток3→ Д+2Б
+t4→ Е+Ж+Д
то сумма всех коэффициентов в уравнении 4-ой стадии равна
A) 18
B) 21
C) 11
D) 19
E) 15
29.Сумма всех коэффициентов в окислительно-восстановительном взаимодействии
NH3 + SO2 → S↓ + N2↑ + H2O
A) 16
B) 17
C) 15
D) 18
E) 12
30.В оксиде углерода (II) столько же π – связей, сколько и в
A) C2H6O
B) C2H4O
C) C2H4
D) C2H6
E) C2H2
Тест по химии.
II – вариант.
1.Наибольшее число атомов углерода содержит
A) деканол
B) пентанол
C) бензол
D) толуол
E) метанол
2.В ходе эндотермической реакции происходит
A) выделение газа
B) поглощение газа
C) поглощение и выделение энергии
D) поглощение энергии
E) выделение энергии
3.Гомологами являются
A) Бутан и октен
B) Бутан и октан
C) Бутан и циклобутан
D) Бутан и бутадиен
E) Бутан и бутен
4.Группа кислотных оксидов
A) CO2, SO2, P2O5
B) Fe2O3, Al2O3, MnO2
C) CaO, P2O5, CO2
D) MgO, Na2O, H2O
E) SO3, H2O, ZnO
5.Группа веществ, которые малорастворимы в воде
A) K2SO4, NaNO3
B) MgCl2, Ba(NO3)2
C) CaSO4, BaSO3
D) BaCl2, AgNO3
E) Na2SO3, Ca(NO3)2
6.Из предложенных элементов к металлам не относится
A) Иттурий
B) Теллур
C) Серебро
D) Цирконий
E) Галлий
7.Скручивание полипептидной цепи за счёт водородных связей между группами в α-спирали, - это
О Н
׀׀ ׀
- С - N –
A) четвертичная структура белка
B) все вышеуказанные структуры белка
C) вторичная структура белка
D) третичная структура белка
E) первичная структура белка
8.Раствор серной кислоты не взаимодействует с
A) магнием
B) медью
C) кальцием
D) цинком
E) барием
9.То же, что органическое стекло
A) Полиметилметакрилат
B) Полипропилен
C) Поливинилхлорид
D) Полиэтилен
E) Полистирол
10.Газообразный продукт взаимодействия фенола с натрием
A) Кислород
B) Угарный газ
C) Водород
D) Этилен
E) Углекислый газ
11.Схема размещения электронов в атоме хрома
A) 1s22s32p63s23p63d4
B) 1s22s32p63s23p63d64s2
C) 1s22s32p63s23p63d14s2
D) 1s22s32p63s23p63d54s2
E) 1s22s32p63s23p63d1
12.Некарбонатную жёсткость воды можно устранить
A) Адсорбцией
B) Действием соли
C) Фильтрованием
D) Кипячением
E) Отстаиванием
13.В состав газового бензина в основном входят
A) Этан и пропан
B) Этилен и пропан
C) Этан и гексан
D) Пентан и гексан
E) Метан и этан
14.К моносахаридам относится
A) сахароза
B) фруктоза
C) мальтоза
D) крахмал
E) целлюлоза
15.Ароматическому углеводороду состава C8H10 соответствует число изомеров
A) 1
B) 3
C) 2
D) 5
E) 4
16.При окислении пропанола – 1 оксидом меди (II) получается
A) Пропанол
B) 2 - метилэтаналь
C) Пропаналь
D) Этаналь
E) Метаналь
17.В ядре атома элемента №21 (45Х) содержится нейтронов
A) 17
B) 19
C) 23
D) 24
E) 22
18.Слово, противоречащее определению скорости химической реакции
A) пропорциональна
B) обратно
C) скорость прямой химической реакции
D) концентрации
E) реагирующих веществ
19.Массовая доля азота наибольшая в
A) NaNO3
B) KNO3
C) LiNO3
D) CsNO3
E) RbNO3
20.Не подвергается гидролизу соль
A) Сульфат железа (II)
B) Сульфат меди (II)
C) Сульфат алюминия
D) Сульфат калия
E) Сульфат железа (III)
21.Количество цинка, которое вступает в реакцию с 40 мл 0,2 М раствора серной кислоты
A) 0,6 моль
B) 0,006 моль
C) 0,06 моль
D) 0,04 моль
E) 0,008 моль
22. В переходе S→Na2SO4 степень окисления, которая изменится для некоторого элемента в реагенте
A) +6, понизится
B) 0, понизится
C) -2, повысится
D) +6, повысится
E) 0, повысится
23.Взорвали смесь, содержащую 80 л (н.у.) хлора и 5 г водорода. Объём образовавшегося хлороводорода равен
A) 160 л
B) 224 л
C) 80 л
D) 112 л
E) 56 л
24.В схеме превращения S 1 (1)→ SO2 (2) → SO3 (3) → CuSO4 окислительно-восстановительной реакцией будет
A) 2
B) 3
C) 1
D) 2, 3
E) 1, 2
25.Если выход при гидрировании составляет 75%, то из 15,6 г бензола получается циклогексан массой
A) 16,60 г
B) 10,60 г
C) 18,60 г
D) 14,60 г
E) 12,60 г
26.Органическое вещество, массовая доля углерода в котором составляет 54,55%, водорода – 9,09%, кислорода – 36,36%, имеет относительную плотность паров по водороду 44. Молекулярная формула этого вещества
A)CH3 – CH2 – CH2 – C = O
׀
OH
B) CH3 – CH – CH2 – CH2 – C = O
׀ ׀
CH3 OH
C) CH3 – CH – C = O
׀ ׀
C2H5 OH
D) CH3 – CH2 – CH2 – CH2 – C = O
׀
OH
E) CH3-С(СН3)2-СООН
27.Для получения 1 кг мыла, которое содержит стеарат натрия с массовой долей 61,2% нужна стеариновая кислота массой:
A) 928 г
B) 370 г
C) 568 г
D) 603 г
E) 1136 г
28.Из уксусной кислоты массой 30 г получили хлоруксусную кислоту, выход которой составил 60%. Через неё пропустили аммиак объёмом 6,72 л (н.у.). Количество вещества аминоуксусной кислоты равно
A) 0,3 моль
B) 0,5 моль
C) 0,2 моль
D) 0,1 моль
E) 0,4 моль
29.Масса алюминия, которая выделится на катоде при пропускании тока силой 6 А через расплав AlCl3 в течение 30 минут
A) 3,2 г
B) 1,25 г
C) 2,8 г
D) 4,1 г
E) 1,0 г
30.В схеме превращений образуется конечны продукт Х4
этаналь Н2,кат → X1 H2SO4 (конц)>140 град. → X2 HCl→ X3 t, Na→ X4
A) изобутан
B) бутен-1
C) бутан
D) бутен-2
E) октан
Тест по химии.
III – вариант.
1.Условная запись химической реакции посредством химических законов и формулы
A) Эмпирическая формула
B) Уравнение Менделеева-Клапейрона
C) Структурная формула
D) Химическое уравнение
E) Молекулярная формула
2.Число электронов в атоме молибдена
A) 42
B) 41
C) 38
D) 34
E) 45
3.В узлах металлической кристаллической решётки находятся:
A) атомы, молекулы и ионы металла
B) молекулы
C) атомы и ионы металла
D) атомы металла
E) ионы металла
4.Относительная молекулярная масса оксида магния МgО равна
A) 64
B) 40
C) 16
D) 76
E) 24
5.Кристаллические вещества, в состав которых входит химически связанная вода
A) Электролиты
B) Гидриды
C) Кристаллогидраты
D) Сольваты
E) Гидроксиды
6.Кислотами называют сложные вещества, которые состоят из атомов
A) металлов, связанных с гидроксогруппами
B) металлов и кислотных остатков
C) неметаллов и кислорода
D) металлов и кислорода
E) водорода, связанных с кислотными остатками
7.Только гидролизом расплава можно получить группу металлов
A) Na, Cu, Ag
B) Li, Ag, Sn
C) Cs, Al, Cu
D) K, Ca, Mg
E) Fe, Ca, Hg
8.Алканы – это углеводороды, которые имеют
A) одинарную связь
B) двойную связь
C) ароматическую связь
D) циклическую связь
E) тройную связь
9.В состав мономера изопренового каучука входят
A) 4 атома углерода и 6 атомов водорода
B) 8 атомов углерода и 10 атомов водорода
C) 5 атомов углерода и 8 атомов водорода
D) 5 атомов углерода и 6 атомов водорода
E) 8 атомов углерода и 8 атомов водорода
10.Продукт переработки нефти, применяемый в дорожном строительстве
A) Смазочные масла
B) Лигроин
C) Вазелин
D) Бензин
E) Гудрон
11.Этиленгликоль и глицерин
A) многоатомные спирты
B) вторичный и третичный спирты
C) полимеры
D) изомеры
E) карбоновые кислоты
12.β – глюкоза является мономером:
A) Сахарозы
B) Целлюлозы
C) Гликогена
D) Мальтозы
E) Крахмала
13.Вторичная структура белковой молекулы напоминает
A) Нить
B) Тетраэдр
C) Глобулу
D) Спираль
E) Разветвление
14.Целлюлоза – … полимер
A) химический и искусственный
B) натуральный и животного происхождения
C) натуральный и растительного происхождения
D) натуральный и синтетический
E) химический и синтетический
15.Сумма коэффициентов в полном ионном уравнении реакции между нитратом бария и серной кислоты (разб.)
A) 9
B) 7
C) 8
D) 10
E) 11
16.Элемент вступает в реакции
а) A+O2→AO
б) A(OH)2→AO+H2O
в) A(NO3)2→AO+NO2+O2
данным элементом может быть
A) Na
B) Hg
C) Cu
D) Ba
E) Ca
17.Реакция получения сероводорода
A) FeS2+Na =
B) FeS+K =
C) FeS+H2 =
D) FeS+HCl (конц.) =
E) FeS2+O2 =
18.Общая сумма коэффициентов в полном ионном уравнении реакции взаимодействия фосфата натрия и хлорида кальция составляет:
A) 30
B) 25
C) 18
D) 32
E) 12
19.Оксид кремния (IV) не взаимодействует с:
A) NaOH
B) H2O
C) BaO
D) CaO
E) CaCO3
20.С железом (при н.у.) будет реагировать
A) NaOH (конц.)
B) HCl (конц.)
C) H2SiO3
D) HNO3 (конц.)
E) H2SO4 (конц.)
21.Если тепловой эффект реакции равен 3924 кДж, то для получения 11772 кДж теплоты, сжигают циклогексан массой
A) 262 г
B) 242 г
C) 252 г
D) 272 г
E) 232 г
22.Плотность вещества по воздуху равна 2,414, а ω(С)=85,71%, ω(Н)=14,29%. Название углерода:
A) Бутен
B) Пентен
C) Этилен
D) Гексен
E) Пропен
23.Масса 5 моль ацетона
A) 290 г
B) 250 г
C) 120 г
D) 150 г
E) 300 г
24.Число изомерных карбоновых кислот состава C2H10O2
A) 3
B) 2
C) 5
D) 1
E) 4
25.Для обоих процессов
а) N2(r) + O2(r) ↔ 2NO(r) – Q
б) 2NH3(r) ↔ N2(r) + 3H2(r) – Q
сместит равновесие влево
A) повышение давления
B) понижение концентрации N2
C) понижение давления
D) повышение концентрации N2
E) понижение температуры
26.Количество вещества хлора, необходимое для приготовления 2 л 1%-ной соляной кислоты с плотностью 1,18 г/моль, равно
A) 0,121 моль
B) 0,464 моль
C) 0,646 моль
D) 0,323 моль
E) 0,232 моль
27.Сумма всех коэффициентов в уравнении реакции сгорания бензола в кислороде
A) 40
B) 20
C) 25
D) 35
E) 30
28.Сумма всех коэффициентов в уравнении взаимодействия бария и концентрированной серной кислоты (при образовании H2S)
A) 21
B) 18
C) 17
D) 20
E) 16
29.Масса анилина, полученная при восстановлении нитробензола массой 246 г, если массовая доля выхода составляет 0,9
A) 167,4 г
B) 197,4 г
C) 157,4 г
D) 177,4 г
E) 187,4 г
30.Масса метанола, необходимого для получения водорода, равного по объёму (при н.у.) водороду, образованному при взаимодействии 23 г этанола с натрием
A) 20 г
B) 14 г
C) 22 г
D) 18 г
E) 16г
Конец теста по химии с 5-10 классы по вариантам (3 варианта).

Ваше имя:
Ваш email: