тест с ответами по теме Подгруппа азота
1Степень окисления азота в ионе аммония равна
A) +5
B) -3
C) -4
D) +3
E) +4
2 Если схема реакции
Ag --+HNO3(конц)--> A --+O2+H2O--> Б --+NaOH--> В -- t=0C --> NaNO2
то сумма молекулярных масс веществ А и В равна
3. Массовая доля нитрата железа (III), полученного растворением 10 г гексагидрата нитрата железа (III) в 100 мл воды, составляет
A) 7%
B) 8%
C) 6,32%
D) 6,28%
E) 6,45%
4 Наибольшее количество кислорода получается при термическом разложении
A) 3 моль нитрата кальция
B) 6 моль нитрата меди (II)
C) 4 моль нитрата натрия
D) 5 моль нитрата свинца (II)
E) 4 моль нитрата бария
5. Массовые отношения элементов в азотной кислоте
A) 1:28:24
B) 2:7:24
C) 1:14:48
D) 1:21:16
E) 2:7:32
6. В схеме превращений
Fe + HNO3 → Fe(NO3)3 + NO + H2O
сумма коэффициентов в сокращенном ионном уравнении равна
A) 11
B) 10
C) 8
D) 12
E) 9
7 Наибольшая массовая доля азота содержится в
A) NO2
B) N2O4
C) NO
D) N2O5
E) N2O
8. Азотная кислота проявляет особые свойства при взаимодействии с
A) Mg, CuO
B) Cu, C
C) MgO, KOH
D) CaO, Mg
E) C, CuO
9. Для процесса
N2(г) + O2(г) ↔2NO (г) – Q
не сместят равновесие факторы
1) повышение температуры
2) понижение давления
3) понижение концентрации О2
4) повышение давления
5) повышение концентрации NO
6) введение катализатора
A) 1 4 6
B) 2 3 5
C) 2 4 6
D) 1 5 6
E) 1 3 5
10 Коэффициент перед формулой восстановителя в уравнении взаимодействия разбавленной азотной кислоты с фосфором, если получается H3PO4 и NO, равен
A) 5
B) 3
C) 2
D) 4
E) 7
12 При прокаливании 12,1 г кристаллогидрата Cu(NO3)2 nH2O получено 4 г сухого остатка. Число n равно
A) 2
B) 6
C) 3
D) 5
E) 4
12. Если взаимодействуют по реакции
C + HNO3 → CO2 + NO + H2O 6 моль восстановителя, то масса окислителя равна (в г)
A) 54 B) 504 C) 120 D) 126 E) 63
13 Плотность азота по воздуху равна:
A) 0,965
B) 0,638
C) 1,23
D) 1,4
E) 1,2
14 При растворении в воде NO2 в присутствии кислорода образовалась кислота, для нейтрализации которой потребовалось 3,2 г гидроксида натрия. Объем NO2 в этой реакции (н.у.)
A) 1276 мл
B) 1768 мл
C) 1692 мл
D) 1736 мл
E) 1792 мл
15. Массовая доля нитрата железа (III), полученного растворением 10 г гексагидрата нитрата железа (III) в 100 мл воды, составляет
A) 6,28%
B) 8%
C) 6,32%
D) 7%
E) 6,45%
16 При взаимодействии разбавленной азотной кислоты с магнием образуется:
A) NH3
B) NH4NO3
C) Mg3N2
D) N2
E) NO2
17 Массовая доля азота наибольшая в
A) RbNO3
B) KNO3
C) NaNO3
D) CsNO3
E) LiNO3
18. После пропускания над катализатором смеси из 7 моль азота и 5 моль водорода не прореагировало 40% водорода. Конечный состав газовой смеси
A) 2 моль аммиака, 2 моль водорода, 6 моль азота
B) 1 моль аммиака, 2 моль водорода, 2 моль азота
C) 3 моль азота, 5 моль аммиака, 5 моль водорода
D) 2 моль водорода, 3 моль азота, 4 моль аммиака
E) 3 моль азота, 4 моль водорода, 4 моль аммиака
19Число частиц Al(NO3)3 в 21,3 г
A) 0,12 молекул
B) 1,48 молекул
C) 6 молекул
D) 1,68 молекул
E) 0,6 молекул
20 6,02 атомов калия реагирует с 12,04 молекулами концентрированной азотной кислоты, при этом образуется оксид азота (IV). Число частиц, не вступивших в реакцию
A) 1,1
B) 4,1
C) 5,1
D) 4,5
E) 6,02
21. Скорость реакции N2(г) + O2(г) = 2NO(г) при увеличении молярных концентраций азота в 2 раза и кислорода в 4 раза возрастет
A) в 8 раз
B) в 6 раз
C) в 32 раза
D) в 4 раза
E) в 16 раз
22 Для получения 1 моль азотной кислоты должны прореагировать объемы оксида азота (IV), кислорода и воды:
A) 2,24 л NO2, 4,8 л О2, 18 мл H2O
B) 2.24 л NO2, 48 л О2, 1,8 мл Н2О
C) 22,4 л NO2, 6 л О2, 12 мл Н2О
D) 0,224 л NO2, 56 л О2, 18 мл Н2О
E) 22,4 л NO2, 5,6 л О2, 9 мл Н2О
23 Масса соли, полученной при взаимодействии 6,4 г меди и концентрированной азотной кислотой
A) 37,6 г
B) 30,8 г
C) 376 г
D) 188 г
E) 18,8 г
24 Сумма молекулярных масс оксидов, полученных при разложении нитрата меди (II)
A) 126
B) 158
C) 46
D) 106
E) 80
25 Сумма всех коэффициентов перед формулами кислот и солей в уравнении
Zn + HNO3 → NH4NO3 + Zn(NO3)2 + H2O
A) 14
B) 13
C) 12
D) 10
E) 15
26 Уравнение диссоциации нитрата магния
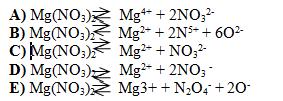
27 X и Y в уравнении реакции меди и разбавленной азотной кислоты
Cu + HNO3 → Cu(NO3)2 + X + Y
A) NO и H2O
B) 2NO2 и 2H2O
C) 2NO и 4H2O
D) NO2 и H2O
E) NO и 4H2O
28Соединение азота с металлом называют
A) Амиды
B) Нитраты
C) Нитриды
D) Нитриты
E) Аммиакаты
29. По 2 моль нитрата и нитрита кальция обработали соляной кислотой. Масса HCl, потраченной на реакцию
A) 109,5 г
B) 292 г
C) 365 г
D) 146 г
E) 73 г
30. Молекула аммиака имеет форму:
A) октаэдрическую
B) линейную
C) плоскостную
D) пирамидальную
E) кубическую
31. При нагревании разлагается на МеО + NO2 + O2 нитрат
A) натрия
B) ртути
C) калия
D) алюминия
E) серебра
32 Степень окисления азота в ряду NH3 → NO → N2
A) Сначала повышается, а потом понижается
B) Повышается
C) Сначала понижается, а потом повышается
D) Понижается
E) Не изменяется
33. Массовая доля фосфора в фосфине:
A) 83%
B) 78%
C) 81%
D) 93%
E) 91%
34 Равновесие реакции 4HNO3 ↔ 4NO2 + O2 + 2H2O – Q смещается в сторону продуктов при:
A) Введении катализатора и понижении температуры
B) Понижении давления и повышении температуры
C) Повышении давления и понижения температуры
D) Введении катализатора и повышении давления
E) Понижении давления и понижении температуры
35 Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции
Mg + HNO3 → Mg(NO3)2 + N2 + H2O
A) 14
B) 10
C) 12
D) 11
E) 8
36 Сумма всех коэффициентов в полном ионном уравнении взаимодействия силиката калия и ортофосфорной кислоты равна
A) 27
B) 24
C) 25
D) 26
E) 28
37 Фосфор – окислитель при взаимодействии с:
A) Азотной кислотой
B) Хлором
C) Хлоратом калия
D) Кислородом
E) Магнием
38 Для получения фосфора в промышленности используют
A) Ca3(PO4)2
B) HPO3
C) P2O5
D) H3PO4
E) Na3PO4
39 Схема реакции, отражающая промышленный способ получения ортофосфорной кислоты:
A) Ca3(PO4)2 + 3H2SO4 = 3CaSO4↓ + 2H3PO4
B) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5 NO↑
C) H4P2O7 --температура→ 2H3PO4 + H2O
D) P2O5 + H2O → 2HPO3
E) P2O3 + H2O = 2HPO2
40 Содержание азота в натриевой селитре:
A) 18%
B) 16%
C) 25%
D) 8%
E) 30%
41. Для обоих процессов
а) N2 (г) + O2 (г) реакция обмена 2NO (г) – Q
б) 2NH3 (г) реакция обмена N2 (г) + 3H2 (г) – Q
сместит равновесие влево
A) понижение температуры
B) понижения давления
C) повышение давления
D) повышение концентрации N2
E) понижение концентрации N2
42 Количество вещества нитрата аммония, которое образуется при пропускании 11,2 л аммиака (н.у.) через 126 г азотной кислоты
A) 0,5 моль
B) 1 моль
C) 2 моль
D) 5 моль
E) 0,2 моль
Ответы на тест по теме Подгруппа азота
1B 2A 3D 4E 5C 6B 7E 8B9C 10B11B 12B 13A 14E 15A 16D 17E 19E 20A 21A 22E 23E 24A 25A 26D 27A 28C 29E 30D31D 32A 33E 34B 35C 36E 37E 38A 39A 40B 41A 42A

Ваше имя:
Ваш email: